Hidrogeochimie - 1
1. PROPRIETĂȚI ȘI STRUCTURA APEI
1.1. Anormalitatea proprietăților apei
Abia la sfârșitul secolului al XVIII-lea și începutul secolului al XIX-lea. a devenit conștient de ceea ce constituie o substanță numită apă. Experimentele lui G. Cavendish, A. Lavoisier, A. Humboldt, J.L. Gay-Lussac a demonstrat că apa se formează din două volume de hidrogen și un volum de oxigen, adică. are o formulă chimicăН2Oși o greutate moleculară de 18. Treptat, însă, a devenit clar că în aproape toți parametrii fizico-chimici această substanță este unică, foarte diferită de alți compuși naturali.
Punctele de topire și de fierbere ale apei
Acestea se bazează pe sistemele de referință de temperatură acceptate.
Selectarea apei pentru a crea scale de temperatură.
Celsius(1701-44). Scara Celsius este 1741.Punctele de fierbere și de topire ale apeila presiunea atmosferică sunt, respectiv, 100 o C și, respectiv, 0 o C,
Reaumur(1683-1757). Scara Réaumur din 1730. Punctul de fierbere al apei este luat ca 80 o (1 o C \u003d 5/4 o R).
Fahrenheit(1686-1736). Punctul de topire al gheții este de 32 o F, punctul de fierbere al apei este de 180 o F (t o C \u003d 5/9 t o F - 32).
Descoperirea legii periodiceD.I.Mendeleev(1869). Discrepanța dintre parametrii fizici ai apei și legea periodică.
Discrepanța cu legea periodică poate fi observată dintr-o comparație a punctelor de fierbere și de topire ale compușilor cu hidrogen ai elementelor grupului de oxigen. Datele pentru H2Se sunt preluate din grafic. Pentru apă, se poate observa că, în conformitate cu legea periodică, punctul de topire al apei ar fi de aproximativ minus 90 °, iar punctul de fierbere - aproximativ -70 °. Apa în condiții „normale” ar fi un gaz toxic, urât mirositor.Viața pe Pământ ar fi imposibilă.
Datorită acestoraCu proprietățile sale „anomale”, apa protejează viața și reglează regimul termic și gazos al planetei noastre.
Capacitatea termică specifică a apei este cea mai mare dintre toate lichidele. Și aici apa este luată ca standard: pentru a încălzi 1 g de apă cu 1 o C pentru a cheltui 1 calorie de energie termică (calor - căldură, lat.). Pentru comparație: gips - 0,27, argilă uscată 0,22 cal. (1 cal = 4,187 J.). Capacitatea termică specifică a gheții și aburului este de două ori mai mică - 0,5 cal/g. deg. Căldura latentă de topire și vaporizare a apei sunt, de asemenea, neobișnuit de mari - 79 și 539 cal. Astfel, pentru a transforma 1 g de gheață cu o temperatură de 0 ° C în abur, trebuie să cheltuiți 79 + 100 + 539 = 718 calorii de căldură. Datorită unei capacități termice atât de ridicate, apa este principalul regulator al regimului termic de pe planeta noastră. Influența Oceanului Mondial afectează aproape toate punctele Pământului, chiar și cele mai îndepărtate de coasta mării, caracterizate prin așa-numita climă continentală. Corpurile mari de apă și, mai ales, Oceanul Mondial, sunt regulatorii regimului termic al Pământului. Pentru stratul de sol, randamentul anual de căldură este de 1,5-3 kcal / cm 2, pentru, de exemplu, Marea Baltică și Marea Neagră 48-52. În absența corpurilor de apă, temperatura ar crește vara și ar scădea cu câteva sute de grade iarna, iarviața pe Pământ ar fiimposibilă;dimpotrivă, dacă Pământul au fost complet acoperite de ocean, amplitudinea anuală a aerului s-ar modifica ar fi de la 0 la ecuator la 5-6 o C la poli. Influența oceanului se extinde la întreaga planetă, inclusiv la polii reci din Antarctica.
Capacitatea termică mare a apei este asociată cu indicatori precumcăldură latentă de fuziune,componenta 333.7 10 3 J/kg,și căldura latentă de vaporizare,componenta 2258.10 3 J/kg, acestea. Este nevoie de o cantitate imensă de energie pentru a transforma 1 kg de gheață în lichid și 1 kg de apă lichidă în abur.Aceasta mărturisește intensitatea energetică ridicată a apei, care predetermina rolul său exclusiv de acumulator de energie în cursul proceselor naturale.
Valoareaconstantei dielectricepentru apă este cea mai mare dintre toate lichidele și este egală cu 80,1 la o temperatură de 20 ° C. La o temperatură de aproximativ 0 ° C este de aproximativ 82 Aceasta înseamnă că atunci când este dizolvată în apă sărată, puterea interacțiunii electrice dintre particulele încărcate opus scade de 80 de ori, ca urmare a faptului că sărurile se disociază în ioni. Majoritatea solvenților nu au mai mult de 50, lichidele nepolare (benzină, kerosen) nu au mai mult de 3. Această proprietate a apei predetermină fenomenuldisocierea electrolitică, adică. capacitatea sărurilor, acizilor, alcalinelor de a se descompune în soluții apoase în ioni încărcați opus. Apa este inertă ca solvent. Aduce nutrienți organismelor vii și elimină toxinele și nu există nimic care să-l înlocuiască. Acea. iar fără această proprietate a apeiviața pe Pământ ar fiimposibilă.
Apa dizolvă mineralele, dar ele renasc dacă apa este evaporată. Această trăsătură are o semnificație geologică și biologică colosală, predeterminand ciclurile apei de diverse ordine, care au loc în câteva ore (la organismele vii) și durează multe milioane de ani în intestinele Pământului (geologice). Aparent, apariția vieții pe Pământ se datorează în mare măsură acestei proprietăți uimitoare a apei.
Toate substanțele au o densitate maximă la punctul de topire, cu excepția apei.Densitatea maximă a apei(1,0 g/cm3) corespunde unei temperaturi de aproximativ 3,98; densitatea gheții 0,918 g/cm3; numai apa nu se scufundă în propria topitură; Thales din Milet a atras atenția asupra acestui lucru. Când apa îngheață, se formează un strat protector subțire de gheață.asigurarea conservării corpurilor de apă, în primul rând Oceanul Mondial - principalul regulator al regimului aerian al planetei. Și fără această proprietate a apeiviața ar lua forme complet diferite.
1.2. Idei despre structura ascunsă a apei
Structura apei.Anii treizeci ai secolului XX au adus o nouă descoperire majoră legată de studiul apei: fizicienii englezi J. Bernal și R. Fowler, pe baza Studiile cu raze X și spectroscopice, au stabilit că moleculele de apă sunt ordonate, fiecare moleculă de apă este înconjurată de alte patru într-un tetraedru. Astfel, afirmația făcută la sfârșitul secolului al XVIII-lea a fost confirmată. V. Roentgen s-a gândit la structura complexă a apei lichide și la existența unor legături suplimentare între moleculele individuale. Oamenii de știință numesc acest fenomenstructura apei,, deși este clar că este imposibil să-l identificăm complet cu rețeaua cristalină a substanțelor solide, deoarece apa lichidă este un amestec de molecule monomerice și polimerice, legăturile dintre monomerii individuali sunt dinamici: apar în mod constant, se descompun, se intensifică, se slăbesc.
Principalul motiv pentru existența structurii apei este un tip special de legătură între atomi individuali - hidrogen. Această legătură este de natură electrostatică, dar este mai slabă decât legătura de valență normală dintre atomii de hidrogen și oxigen care formează monomerii individuali. În fiecare monomer H2O, distanța dintre atomii de hidrogen și oxigen este de 0,1 nm, iar unghiul format între legăturile de valență este de aproximativ 105º. Într-o legătură de hidrogen, distanța dintre atomi crește la 0,176 nm și nu este strict constantă.
Există mai multe modele ale structurii apei bazate pe ideea de a conecta monomeri individuali prin legături de hidrogen. J. Bernal și R. Fowler au sugerat existențatrei tipuri de aranjare a moleculelor: a) structuri care se apropie de rețeaua cristalină a gheții există la temperaturi de la 0 la 4ºС; b) structuri precum cuarțul, predomină la o temperatură de 4-200ºС; c) structuri compacte tipice lichidelor normale (aproape lipsite de legături de hidrogen) apar la temperaturi peste 200 ºС [Blokh A.M. Structura apei și procesele geologice.L., 1969, p. 216].
O abordare interesantă a interpretării caracteristicilor structurale ale apei a fost propusă de fizicianul italian M. Angeno (1967). Conform ideilor sale, fiecare moleculă de apă poate participa la nu mai mult de două, dar așa-numitele legături colective de hidrogen, în urma cărora combinația de valență și legături de hidrogen formează unități de diferite tipuri (Fig. 1).
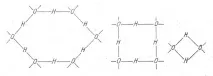
Orez. 1. Agregate moleculare în apă lichidă (după M. Ajendo).
Aceste legături pot forma lanțuri, inele și sisteme mai complexe care se formează continuu, sunt distruse și schimbă molecule. În acest caz, numărul total de punți de hidrogen din sistem rămâne constant și tipurile posibile de agregate sunt prezente în apă în proporții diferite într-un echilibru static determinat de temperatură. Inele de șase molecule par să se apropie de structura gheții.
Din punctul de vedere al structurii structurale a apei lichide, sunt explicate toate proprietățile sale anormale. Necesitatea distrugerii legăturilor de hidrogen predetermina intensitatea energetică mare a apei, în urma căreia punctele de topire și de fierbere, capacitatea de căldură și căldura latentă de topire și vaporizare devin anormal de ridicate. Când apa este răcită în intervalul de temperatură de la 4 la 0ºС, structura este restructurată de la un strat de gheață mai dens tetragonal la hexagonal. Legătura puternică dintre moleculele de apă îl face inert la dizolvatsubstante. Întrucât structura apei este formată din legături electrostatice, aceasta este afectată de diverse câmpuri (temperatură, geodinamică, magnetică, electrică).
Când se aplică presiune, moleculele de lichide se apropie unele de altele și vâscozitatea lor crește. Apa se comportă destul de diferit. Primele etape de încărcare duc la o restructurare a structurii apei, umplerea golurilor intermoleculare, însoțită de o scădere a vâscozității acesteia și abia pornind de la presiuni de aproximativ 100 MPa (suficient de mare pentru condițiile naturale) începe o creștere treptată a vâscozității.
1.3. Soiuri de apă
Proprietățile structurale ale apei și existența mai multor izotopi ai oxigenului și hidrogenului sunt motivul pentru care apa poate forma multe specii fizico-chimice. Aici sunt câțiva dintre ei.
Idei despre apa activată
Experimentele oamenilor de știință din Novosibirsk (F.A. Letnikov și alții) privind tratarea apei în autoclave la temperaturi de 300-400 ºС și presiuni de până la 100 MPa au arătat că acest lucru crește puterea de dizolvare a apei pentru multe minerale (la sulfuri, gips, cuarț), pH-ul scade, conductivitatea electrică crește. Influența temperaturii și presiunii asupra modificării structurilor apei a condus experții la ideea posibilității de a simula proprietățile apei situate la adâncimi mari (adică la temperaturi și presiuni ridicate) și a condus la descoperirea numităapă activată<2. După tratarea apei în autoclave Detectarea unei stări activate în apa izvoarelor minerale termale sugerează că proprietățile curative ale unor tipuri de ape minerale pot fi asociate nu numai cu compoziția lor chimică, ci și cu o creștere a activității biologice a apei. când este activat. Descoperirea fenomenului de activare nu numai că face posibilă explicareaunele proprietăți ale soluțiilor hidrotermale, dar deschide și perspective pentru prepararea artificială a apelor minerale.
Influența câmpului electric
Când apa este plasată într-uncâmp electric, pot apărea anumite modificări ale structurii sale. Deci, curentul electric slăbește legăturile structurale, iar după tratarea apei cu curent electric alternativ, viteza de evaporare crește, conform puținelor date disponibile, cu 11-18%. S-a remarcat influența câmpurilor electrice asupra intensității absorbției razelor de lumină de către apă.
Influența câmpului magnetic
Apa-II.La începutul anilor '60 ai secolului XX. N.N. Fedyakin a descoperit un fenomen extrem de interesant: atunci când vaporii de apă se condensează în capilare subțiri de cuarț (5-20 microni în diametru), se formează un lichid, care diferă semnificativ în proprietăți de apa obișnuită. Ulterior, acest lichid, numit apă-II, a fost studiat de mari cercetători români și străini, în special de o mare echipă de oameni de știință condusă de B.V. Deryagin. Sa constatat că apa-II este un lichid vâscos cu o densitate de aproximativ 1 g/cm3 și un indice de refracție de 1,49 (față de 1,33 pentru apa obișnuită). Acest lichid trece în stare solidă la răcire la minus 35÷40 ºС fără salt de volum. Punctul de fierbere al apei-II la presiunea atmosferică este de aproximativ 250 ºС. Water-II are un spectru unic de absorbție în infraroșu care nu corespunde cu niciuna dintre substanțele cunoscute. Starea modificată a substanței obținute este stabilă și se păstrează în timpul distilării (această procedură a fost folosită pentru a îngroșa porțiuni de apă-II). S-a dovedit că substanța nou obținută corespunde strict cu formula H2O; cuarțul, aparent, joacă rolul unui catalizator în sinteza apei-II.
Cercetarea apei-IIa condus B.V. Deryagin și colaboratorii săi au ajuns la concluzia cu privire la posibilitatea existenței unui tip special de legătură moleculară puternică între hidrogen și oxigen, care formează polimeri formați din 6-10 molecule monomerice de H2O. Este încă greu de determinat rolul apei-II în sistemele naturale, dar este clar că studiul acesteia promite anumite perspective în studiul proceselor geologice profunde.
Apă grea.În prezent, sunt cunoscuți trei izotopi ai hidrogenului ( 1 H-protiu, 2 H-deuteriu D, 3 H-tritiu T) și trei izotopi ai oxigenului ( 16 O, 17 O, 18 O). Aceasta înseamnă că poate exista un număr semnificativ de soiuri de apă cu diferite combinații de izotopi. Cea mai stabilă dintre ele este așa-numita apă grea D2O, conținută ca impuritate în apa obișnuită în sutimi de procent. După proprietățile sale, apa grea diferă semnificativ de apa obișnuită: densitatea maximă se notează la t=11,2 ºС și este de 1,056 g/cm 3 ; vâscozitatea este cu 20% mai mare; constanta dielectrică este cu 0,3-0,5% mai mică. Punctul de topire al apei grele este de 3,8 ºС; punctul de fierbere 101,4 ºС. Judecând după datele date și după o serie de alte date, legătura de deuteriu este chiar mai puternică decât legătura de hidrogen.Apa grea este folosită ca moderator de neutroni în reactoarele nucleare. Apa grea este toxică, ființele vii și plantele mor în ea. Unii oameni de știință asociază evoluția vieții de pe planeta noastră cu modificări ale concentrației de deuteriu în apă: în special, concentrația mai mică de deuteriu în apă în comparație cu concentrația modernă de deuteriu în apă explică existența ierbivorelor gigantice în Mezozoic. Cu toate acestea, aceste prevederi sunt controversate.
Exemplele de soiuri de apă prezentate aici, predeterminate de structura sa complexă și izotopia, arată cât de inepuizabile sunt perspectivele apariției unor noi descoperiri lastudiul unei substanțe atât de uimitoare precum apa.