Termeni atomici - Manualul chimistului 21
Chimie și tehnologie chimică
Termeni atomici
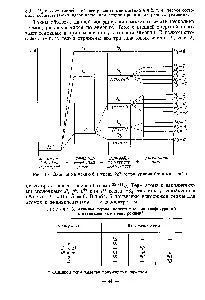
Termeni atomici. Schema Russell-Saunders.[c.39]
Pentru a desemna termeni atomici aparținând diferitelor sisteme multiplete, în stânga sus cu literele 5, P, 0, P,. . puneți numărul 25 + 1, numit multiplicitatea termenului unde 5 este numărul cuantic care determină spinul total al atomului. Indicele din dreapta jos indică valoarea momentului total J Numărul cuantic J merge de la 1 + 3 la b - 5. Astfel, dubleții R-termeni ai metalelor alcaline (1=1, 5 = /r, J = l 2, sunt notați prin simbolurile Ru, P /,. Să presupunem că atomul are 1=2 și 5=1, atunci desemnarea termenului va fi Yu, dar deoarece valorile posibile ale lui J = 3, 2, 1 (Y=2+1=3, Y=2+1-1=2, Y=2+1-2 =[c.69]
Descrierea stării unui atom folosind numerele cuantice L și 5 se numește schema Russell-Saunders. La aceeași configurație pot corespunde stările (termeni atomici) cu valori diferite ale lui L și valori diferite ale lui S. Termenii atomici cu diferite L diferă foarte mult ca energie, așa că sunt introduse denumiri speciale pentru ei[c.40]
Termeni atomici. Regulile Gund[c.51]
Deci, starea unui atom poate fi caracterizată prin numerele cuantice ba, care determină momentele orbitale și de spin ale atomului. O astfel de descriere se numește schema Russell-Saunders Una și aceeași configurație poate corespunde stărilor cu valori diferite ale lui b și valori diferite. Aceste stări diferă foarte mult ca energie în fiecare dintre ele, vectorii / sunt orientați diferit, deoarece rezultat al căruia repulsia interelectronului aduce diferite contribuții la energia electronică totală a atomului. Acesta din urmă este de obicei exprimat în cm, iar stările de energie cu date și 5 se numesc termeni atomici. Termenii atomici denotălitera majusculă a alfabetului latin în conformitate cu valorile numărului cuantic V[c.52]
Dacă subnivelurile p-, (1-, / etc. nu sunt ocupate complet de electroni echivalenti, mai multe stări de energie, numite termeni atomici, corespund unei configurații. Acesta este rezultatul interacțiunii electronilor. De exemplu, din schema de umplere a orbitalilor atomici ai carbonului cu doi electroni/-echivalenți ( Fig. 23) arată că configurația 2p corespunde atât stării a, când numărul de electroni neperechi din atom este zero, cât și stării bb, când aceasta numărul este egal cu 2. Starea bb este mai stabilă decât a, deoarece electronii[c.51]
Astfel, mai mulți termeni care diferă ca energie pot corespunde acestei configurații. Termenul cu cea mai mică energie se numește principal și este luat drept zero al citirii energiei. Toate cele trei numere cuantice 5 și Y sunt reflectate în întreaga eim-voință a termenului atomic,[c.41]
Teoria câmpului cristalin (CFT) dezvoltă opinii asupra interacțiunii electrostatice dintre elementul d ca ion central și ionii de semn opus sau molecule polare. În acest caz, se ia în considerare natura mecanică cuantică a electronilor agentului de complexare. Bazele acestei teorii au fost formulate în 1929 de G. Bethe în lucrarea sa Splitting of atomic terms in a crystal. Teoria electrostatică a considerat ionul metalic ca un nucleu atomic înconjurat de un nor de electroni sferic. Teoria câmpului cristalin presupune că electronii d formează nori de electroni nesferici prin umplerea selectivă a orbitalilor de energie joasă direcționați între liganzi. În această teorie, ionul central al elementului d este considerat luând în considerare structura sa electronică, participarea electronilor de valență, iar liganzii sunt considerați fără structură casurse de câmp electrostatic. Acesta este dezavantajul teoriei. Într-un ion sau atom al unui element de tranziție fără mediu extern, energia tuturor celor cinci d-orbitali (d y, d z, d 2 X. iar dubletul este formal, o singură stare cu 7 \u003d / 2 este posibilă pentru termen.[c.53]
Astfel, pentru aceeași configurație electronică a unui atom sunt posibile stări cu valori diferite ale lui b și 5. Starea cu b dat și dat 5 determină termenul atomic b. Multiplicitatea lui 25-1-1 înseamnă că sub influența interacțiunii spin-orbital termenul este împărțit în 25-1-1 componente caracterizate de o anumită valoare a numărului cuantic /. Fiecare dintre componentele termenului corespunde unei anumite energii. Diferența de energie între termenii individuali ai unei configurații date este semnificativă, dar între componentele unui termen dat este mică, așa cum se poate vedea din exemplele pentru atomul de carbon. Sistemul de termeni atomici este confirmat de studiile proprietăților magnetice și optice ale atomilor.[c.56]
Formula (14.1) este valabilă pentru atomii corpurilor în stare gazoasă, când interacțiunea momentelor magnetice ale atomilor vecini este practic nulă și pentru acele cazuri în care această interacțiune poate fi neglijată. Măsurând q şi comparându-l cu valoarea calculată prin (14.1), se poate convinge de corectitudinea definiţiilor termenilor atomici.[c.56]
Pe baza datelor experimentale privind spectroscopia atomică și calculele teoretice ale energiilor diferitelor stări, au fost elaborate reguli generale pentru clasificarea stărilor atomice și secvența lor energetică. O anumită stare de energie a unui atom se numește termen atomic.[c.81]
Momentele totale orbitale și de spin ale impulsului dintr-un atom nu sunt independente unele de altele, deoarece fiecare dintre ele este asociată cu propriul său moment magnetic.Interacțiunea câmpurilor magnetice create de aceste momente se numește interacțiune spin-orbita. Ea provoacă o serie de efecte subtile asociate cu divizarea suplimentară a termenilor atomici și face posibilă explicarea structurii fine a spectrelor atomice, în special, a structurii dublete a spectrelor metalelor alcaline. O luare în considerare riguroasă a interacțiunii spin-orbita este posibilă prin rezolvarea ecuației relativiste Dirac. Cu toate acestea, abordarea semiclasică face posibilă dezvăluirea celor mai importante detalii ale acestui efect.[c.70]
O anumită stare de energie a unui atom se numește termen atomic. Clasificarea termenilor (în aproximarea cu 5 legături) se realizează în conformitate cu valorile orbitalului, spinului și momentelor totale ale atomului. Termenii sunt notați după cum urmează. În stânga sus, este scrisă multiplicitatea stării, determinată de valoarea spinului total 5 și arătând numărul de valori posibile ale proiecțiilor impulsului total de spin. În funcție de spin, stările sunt numite după cum urmează[c.74]
Simbolul unui termen atomic se scrie ca[c.37]
Indicii gnu care însoțesc simiolii termenilor atomici sunt utilizați aici în același sens ca și pentru moleculele homonucleare ei caracterizează comportamentul funcțiilor de undă corespunzătoare în raport cu reflexia. Funcția de undă este pară (g) când suma lui 2/f pentru toți electronii este pare; funcția de undă este impară (u) când suma lui 2/r este impară. În spectroscopie atomică, de obicei nu se folosește notația g n, dar stările impare sunt caracterizate de indicele o, fără a indica în mod specific caracterul par al funcțiilor.[c.41]
În tabel. 12.6 rezumă rezultatele aplicării acestui tip de analiză la majoritatea termenilor atomici importanți care decurg din configurațiile /"-.[c.261]
De aici rezultă căDiscuția calitativă a cazului configurației / în cazul inversării de scindare din cauza câmpului liganzilor este la fel de aplicabilă și în cazul configurației /. Imaginea pentru configurația / nu este chiar inversă imaginii pentru configurația /, deoarece ordinea termenilor atomici este aceeași. Pe rns. 12.12[c.269]
Definirea simbolurilor termenilor pentru molecule se realizează în mod similar cu definiția simbolurilor pentru termenii atomici. Dacă toate nivelurile moleculei sunt complet umplute, atunci starea sa de spin este un singlet complet antisimetric, iar starea spațială trebuie să fie complet simetrică, iar o astfel de stare corespunde simbolului S + din grupul de puncte Do h- Dacă există niveluri. nu sunt complet populate, atunci funcțiile spațiale și de rotație ar trebui să fie proiectate.[c.230]
Deoarece nivelurile degenerate din complexele de coordonare pot fi parțial umplute, pot apărea termeni diferiți din aceeași configurație electronică. Acești termeni pot fi găsiți prin metode deja cunoscute de noi. Secvența energetică a termenilor nu poate fi stabilită pe deplin fără a efectua efectiv calcule ale stărilor cu mai mulți electroni. Dar unele concluzii calitative despre această secvență pot fi făcute pe baza luării în considerare a termenilor atomici în limita unui câmp slab și a configurațiilor în limita unui câmp puternic.[c.323]
Absorbind energie, A. trece de la principal. stări cu un minim de energie într-una dintre stările excitate, configurația sa electronică se modifică în acest caz. Fiecare A. are un sistem de energetică discretă inerent numai lui. state, la-Crimeea corespund cu anumite. niveluri de energie. Acestea din urmă converg către așa-numitele. limita de ionizare (limită de ionizare), care corespunde valorii energiei necesare pentru a desprinde un electron de la A. în principal. condiție. cuantictranzițiile între nivelurile de energie ale atomilor liberi sau care interacționează slab determină spectre atomice. Proporțional cu energia stării A. valoarea, exprimată în cm, numită. termo atomic.[c.58]
O versiune mai simplă a lui P. l. t. - teoria cristalinului. câmpuri în care liganzii sunt modelați prin sarcini punctiforme (s, dipolii IT. p., în timp ce orbitalii centrului atomului sunt considerați în mod explicit. Se presupune că caracteristicile spectrale și alte caracteristici ale complexelor de metale de tranziție sunt complet determinată de raportul dintre energiile orbitalilor obținuți din orbitalii d sau f inițiali ai centrului, un atom aflat sub influența câmpului cristalin al sarcinilor punctiforme-liganzi, precum și modul în care acești orbitali sunt umpluți cu electroni. .Ca si in teoria campului liganzilor, se presupune ca intr-un camp slab, liganzii au un efect redus si pastreaza semnificatia clasificarii termenilor atomici ai centrului, ai atomului in functie de impulsul orbital. este determinată de interacțiune.(-electroni între ei. În cazul unui câmp puternic influența liganzilor este foarte puternică și stările atomice cu un anumit moment orbital își pierd sensul. Împărțirea nivelurilor d este determinată de câmp a liganzilor, iar interacțiunea lor poate fi considerată ca o perturbare (vezi Degenerarea stărilor energetice.) Dispunerea finală a nivelurilor stărilor rezultate se determină ținând cont de posibila multiplicitate de termeni.[c.473]
Fiecare dintre nivelurile de energie ale unui atom liber corespunde unui anumit moment de impuls și paritate. În plus, dacă energia ionului nu depinde de momentul unghiular total al spinului 8, atunci și 8 își păstrează valoarea, deoarece în acest caz comută cu. Rezultă că și momentul unghiular orbital b își păstrează valoarea, deoarece A = b + 8. Această concluzie stă la baza schemei de comunicare ptRussell-Saunders, fiecare nivel de energie atomică este caracterizat de anumite valori ale lui b și 8. Nivelurile atomice sunt notate cu simbolul 8 + H și se numesc termeni atomici. Starea electronică de bază a unui ion cu un electron de 3, de exemplu, sau este 0 8 \u003d Y2, \u003d 2) la o distanță de 80.000 cm- - și, respectiv, 148.000 cm, deasupra stării fundamentale, primul starea excitată 8 este situată, corespunzătoare configurației ( )45, unde parantezele ( ) indică învelișuri pline cu electroni. Pentru o astfel de configurație, ca (caracteristică a ionului Cr ", există mai mulți termeni. Pentru ionul Cr + starea electronică de bază P 8 \u003d 3/2, b \u003d 3) și peste această stare cu 14.000 există o starea P 8 \u003d 3/2 , 1 = 1. Alți termeni sunt P,[c.71]
În cazul neglijării interacțiunilor neelectrostatice, termenii din Hamiltonianul total (5.2) nu sunt luați în considerare. 3 externe și 5 interne, adică contribuții asociate cu existența spinurilor electronilor și nucleelor, precum și cu influența câmpurilor externe. Această aproximare este utilizată în aproape toate metodele de chimie cuantică. Studiul cuplării spin-spin (interacțiunea dintre dipolii magnetici ai două particule încărcate datorită mișcării lor de spin) și cuplarea spin-orbită (interacțiunea dintre dipolii magnetici ai particulelor încărcate datorită mișcărilor de spin și orbitale) este important pentru studiul structurii fine a termenilor atomici. Mărimea acestor efecte crește odată cu creșterea numărului ordinal al elementului. Vom lua în considerare hamiltonianul extern atunci când studiem efectul câmpurilor externe asupra unui sistem molecular (când interpretăm spectrele RMN și EPR).[c.87]
Vezi paginile în care este menționat termenulTermeni atomici :[c.96] [c.41] [c.295] [c.53] [c.415] [c.169] [c.415] [c.36] [c.58][c.473] [c.245] [c.224] [c.265] Urmăriți capitolele din:
Dicţionar enciclopedic chimic (1983) -- [ c.570 ]
Marele Dicționar Enciclopedic Chimie ed.2 (1998) -- [ c.57 ]
Curs de mecanică cuantică pentru chimiști (1980) -- [ c.183 ]