Metode electrochimice de protectie anticoroziva - protectie catodica - Studopedia
Esența acestor metode constă în faptul că, în eventualitatea apariției celulelor galvanice, metalul protejat este evident catodul, deoarece metalul anod este întotdeauna distrus prin oxidare. Pentru a crea astfel de celule galvanice, se folosește un metal mai activ sau o sursă de curent continuu extern.
Folosind mai multe metale active
Una dintre opțiunile pentru această protecție poate fi atribuităacoperirilor metalice „anodice” de mai susdupă încălcarea parțială a acestora.
Dacă în volumul metalului de protejat se introduce un metal mai activ,se formează aliaje rezistente la coroziune.În special, oțelurile cu crom sunt oțeluri rezistente la coroziune. Cu un conținut de crom de peste 20%, sunt foarte rezistente la toate tipurile de coroziune, fiind adesea numiteinoxidabile.Cromul are un potențial mai mic decât fierul, deci fierul în celulele microvoltaice care se pot forma pe suprafața va fi catodul.
Metalele active (avand valori de potential mai mici) sau aliajele care le contin sunt folosite ca protectoare.Protectorul metalic este atasat de suprafata structurii metalice protejate. De obicei, se folosesc mai multe protectoare, atașate unei singure structuri. Se formează celule galvanice în care metalul protejat este catodul, iar protectorul este anodul. Pentru a proteja produsele din oțel, aliajele pe bază de zinc sau magneziu sunt folosite ca protectori (Fig. 17).
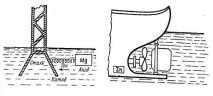
a) - suport de linie electrică; b) - carena navei
Figura 17 - Schema de protecție a benzii de rulare
Luați în considerare protecția unei structuri de oțel folosind protectori de magneziu în apă cu pH = 7. Magneziul este un anod (E ° Mg / Mg 2+ = -2,38 V,
E ° Fe / Fe2 + = -0,44 V), și este distrus, iar oțelul este catodul, iar oxigenul este redus la suprafața sa. Procesul de recuperare nu afectează și nu schimbă metalul catodului, astfel încât până când protectorii nu sunt complet distruși, coroziunea pe suprafața structurii de oțel nu va apărea.
Anod: Mg│Fe° - 2 e→Fe 2+
Catod: Fe│О2 + 2Н2О + 4 e → 4 (OH)-
Protecția de protecție este de obicei folosită ca metodă suplimentară de protecție în combinație cu diferite acoperiri de impermeabilizare.
Protecție împotriva coroziunii electrice
Esența protecției electrice (protecție cu curent continuu suprapus) este că structura metalică protejată este conectată la polul negativ al unei surse externe de curent continuu (redresor, generator), deci va fi catodul, iar anodul va fi un electrod auxiliar. , de obicei oțel, fontă (sau metal), care este conectat la polul pozitiv al sursei de curent (Fig. 18).
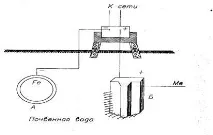
A) - conducta de otel protejata (catod);
B) - electrod auxiliar (anod)
Figura 18 - Schema de protectie electrica
Protecția electrică este folosită cel mai adesea pentru structurile masive din oțel în apă sau sol, de obicei în combinație cu acoperiri izolante. Avantajele protecției electrice sunt ușurința în reglarea curentului furnizat și menținerea necesarului
potențialul de scut, precum și posibilitatea de a folosi ca anozi metale feroase ieftine sau fier vechi.
În timpul protecției electrice catodice pe suprafața metalului protejat (catod), în funcție de valoarea pH-ului și de compoziția mediului, ionii de hidrogen sau moleculele de oxigen se reduc, iar metalul auxiliar (anodul) este distrus.
Luați în considerare reacțiile de laprotecția electrică a unei conducte de oțel situată într-un mediu neutru (metalul electrodului auxiliar este indicat prin simbolul Me).
Anod: Me│ Me 0 - 2 e → Me 2+
Catod: Fe│О2 + 2Н2О + 4 e → 4 (OH)-
Nu ați găsit ceea ce căutați? Utilizați căutarea:
Dezactivați adBlock! și reîmprospătați pagina (F5)este cu adevărat necesar