În faza de inițiere,...
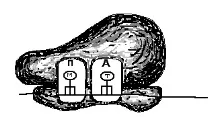
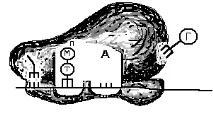
2. Alunecând de-a lungul ARNm, subunitatea mică „găsește” codonul de început situat în apropierea „capacului”. În acest moment, subunitatea se oprește și se fixează pe ARNm. S-a format un sistem format din două elemente - o subunitate mică și o catenă de ARNm. Sistemul este aranjat astfel încât doar 2 codoni să fie localizați în subunitatea mică, fiecare dintre ei ocupând propria sa regiune sau centru activ, sau P sau A. Codonul de început este situat în centrul funcțional „P” (Fig. 66, A). Într-un alt centru funcțional (A) se află codonul primului aminoacid inclus în proteină. Subliniem încă o dată că doi centri funcționali din subunitatea mică nu sunt activi. Ele sunt activate numai atunci când sunt atașate la o subunitate mare, în care există centre similare P și A.
Codonul Cap Start
B+ =

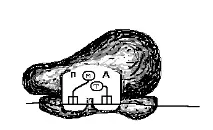
Orez. 66. Schema formării complexului inițiator și a ribozomului. A - subunitatea mică a ribozomului se leagă de ARNm. B - anticodonul metionină-ARNt se conectează la codonul ARNm din situsul „P”. Se formează un complex de inițiere. B - complexul de inițiere se conectează la subunitatea mare a ribozomului. Se formează ribozomul.
În multe organisme, codonul de început (sau codonul de inițiere) din ARNm conține un triplet complementar anticodonului aminoacil-ARNt care poartă metionină. De regulă, sinteza proteinelor începe cu codonul metionină.
3. Un aminoacil-ARNt care poartă aminoacidul metionină este atașat la codonul de început situat în secțiunea „P”. Complexul format din subunitatea mică a ribozomului, ARNm, metionină-ARNt se numește complex de inițiere (Fig. 66, B).
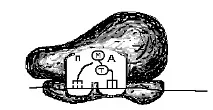
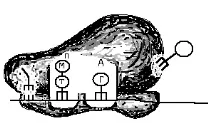
De îndată ce subunitatea mare a ribozomului se alătură complexului de inițiere, începe etapa de inițiere. Cu adăugarea unei subunități mari în ribozom, două se completeazăcentrii funcționali „P” și „A”. Ambele centre găzduiesc doar doi codoni ARNm. În centrul „P” este metionină-ARNt, iar la locul „A”, care este deschis către citoplasmă, ei încearcă să se atașeze aminoacil-ARNt purtând diferiți aminoacizi. Doar acel aminoacil-ARNt se unește, al cărui anticodon este complementar codonului ARNm situat în situsul „A”. În cazul nostru, triptofan aminoacil-ARNt (T) intră în situsul „A” (Fig. 67, C, D).
complex inițiator
3'
B

3' 3'
Orez. 67. Schema de traducere. A - componente ale aparatului de translație (subunități mici, mari de ribozomi, ARNm, aminoacil-ARNt, ARNt și aminoacizi) în citoplasmă înainte de începerea sintezei proteinelor. B - complex inițiator. B - începutul alungirii. Subunitatea mare și mică sunt conectate, în centrul funcțional „P” al aminoacil-ARNt cu metionina (M). D - în centrul funcțional „A” al aminoacil-ARNt cu triptofan (T). D - legătura aminoacizilor metionină și triptofan în centrul funcțional „A”. G - mișcarea aminoacizilor împreună cu ADN-ul către centrul „P”. H - centrul „A” este umplut cu aminoacil-ARNt, care poartă aminoacidul glicină (G).
Enzimele speciale conectează doi aminoacizi situati în zonele funcționale între ele printr-o legătură peptidică (Fig. 67, E). În același timp, apare un decalaj între ARNt și aminoacidul metionină. Metionina rămâne atașată la triptofan în situsul „A”, iar în situsul „P” există un ARNt eliberat de aminoacid (Fig. 67, E). O enzimă specială, folosind energia macroergilor (ATP), avansează ribozomul de-a lungul ARNm cu un triplet (pas) către capătul 3’ al ARNm. În același timp, ARNt este eliberat din situsul „P” și intră în citoplasmă și locul său.ocupată de aminoacil-ARNt purtător de triptofan (T) și metionină (M) atașate la triptofan. Centrul „A” devine liber și alte aminoacil-ARNt citoplasmatice încep să revendice codonul ARNm din el (Fig. 67, G). Este atașat acel aminoacid, al cărui anticodon este complementar codonului ARNm „A” al situsului (Fig. 67, H). Apoi ciclul se repetă.
Responsabilitățile funcționale ale subunităților mici și mari ale ribozomilor sunt diferite. Subunitatea micăatașează aminoacil-ARNt(adică decodifică informații), iar subunitatea mare este responsabilă pentruformarea unei legături peptidice între aminoacizi.
Sfârșitul translației are loc atunci când unul dintre codonii de oprire (UAG, UAA, UGA) intră în secțiunea „A” a ribozomului. Pentru ei, nu există aminoacil-ARNt corespunzători și procesul de sinteză a proteinelor se oprește.
Factorii de terminare (proteine) sunt atașați de codonul stop, care activează enzimele situate în ribozomi. Aceste enzime, la rândul lor, efectuează procesul de scindare a proteinei sintetizate din ARNt și provoacă disocierea ribozomului în subunități.
Trebuie remarcat un fenomen interesant observat la terminare. Anterior, am observat (a se vedea secțiunea „Procesare”) că capătul catenei de ARNm, unde se află terminatorul, se termină cu o „coadă” de poliadenil - Poly-A. La sfârșitul sintezei polipeptidei, ribozomul părăsește catena de ARNm, „mușcând” o bază adenil din Poly-A. Următorul ribozom, după ce a finalizat sinteza, se desparte și de o bază și așa mai departe. Odată ce toate bazele s-au pierdut, ARNm este degradat de enzime. Astfel, Poly-a este un fel de ceas biologic care măsoară durata existenței ARNm și cantitatea de proteine sintetizate dintr-un anume ARNm. Mai lung decât Poly-A - din aceasta vor fi sintetizate mai multe molecule de proteineARNm și invers.
g. Întreruperea traducerii.
Translația, ca și alte procese de sinteză a matricei, poate fi perturbată de diverși factori ai mediului intern și extern. Destul de des, astfel de încălcări sunt asociate cu impactul asupra procesului de agenți chimici de o natură foarte diferită. În practica medicală, o încălcare a procesului de traducere poate apărea cu utilizarea antibioticelor. În acest caz, mecanismul de deteriorare a ADN-ului se bazează cel mai adesea pe trei fenomene.
1. Un antibiotic se poate lega de centrul activ al ribozomului (de exemplu, de centrul „P” sau „A”) și poate bloca interacțiunea participanților la procesul de traducere cu acest centru. Deci, streptomicina se leagă de „P”, iar tetraciclina de centrul „A” al ribozomilor din microorganisme, suprimând complet activitatea acestora. Trebuie remarcat faptul căribozomul uman are o structurădiferită a acestor centri, astfel încât aceste antibiotice nu se leagă de ei. Cu toate acestea, un alt antibiotic, puromicina, se leagă de centrul „A” al ribozomilor umani și oprește translația. Este clar. că ca medicament poate fi folosit cu foarte mare grijă.
2. Un alt mecanism de acțiune al substanțelor care încalcă sinteza proteinelor este atașarea lor la orice enzimă care participă la sinteza. În acest caz, enzima este oprită din proces. Deci toxina difterice inactivează unele enzime în stadiul de alungire.
3. Mecanismul îndepărtat de acțiune al compușilor chimici constă în efectul unui agent chimic nu asupra procesului de translație în sine, ci asupra structurilor care îi determină cursul. Astfel de structuri sunt situate în diferite zone ale celulei. Pot fi receptori situati pe suprafata membranei plasmatice. Un agent chimic, care se leagă de un receptor, induce un lanț de reacții biochimice în citoplasmă,care afectează intensitatea traducerii, până la încetarea completă a acesteia. Așa funcționează interferonul.
MZ. Aceasta este traducerea informațiilor din secvența de polinucleotide ARNm în secvența de aminoacizi a proteinei. Această traducere este realizată prin sinteza proteinelor pe o matrice - ARNm. Traducerea implică ribozomi, ARNt, ARNr și diverse enzime. Se compune din trei etape - inițiere, alungire și terminare. În stadiul de inițiere, se formează un complex de inițiere, care constă dintr-o mică subunitate a ribozomului, ARNm, ARNt care poartă metionină. După ce subunitatea mare a ribozomului este atașată de aceasta, începe etapa de alungire, care constă în atașarea ARNt-urilor care transportă aminoacizi la ARNm și legarea aminoacizilor între ei. Procesul are loc în doi centri activi situati la granița subunității mici și mari. Traducerea se termină atunci când un codon „fără sens” care nu codifică aminoacizi intră în ribozom.