Cum a descoperit Faraday legea electrolizei
În ciuda faptului că Faraday a fost autodidact, avea cunoștințe mari în domeniul științelor sale preferate - chimie și fizică. În 1811, Faraday, în vârstă de douăzeci de ani, a auzit despre descoperirile oamenilor de știință italieni Galvani și Volta, care au creat un element electric care era o sursă de curent electric. Faraday a decis să facă imediat o baterie de celule galvanice. Într-un magazin de produse chimice, a cumpărat plăci subțiri de zinc și a tăiat șapte discuri mici din ele. Apoi a pus o monedă de cupru pe fiecare disc. Într-o soluție apoasă de clorură de sodiu, de ex. Pur și simplu a pus, într-o soluție de sare de masă, Faraday a umezit bucăți de hârtie și le-a așezat între perechi de cercuri de zinc și cupru. Mica baterie electrică era gata. Acum a fost posibil să se înceapă studiul proprietăților unei noi surse de curent. Faraday a decis să-și atașeze bateria cu bucăți de sârmă la un vas umplut cu o soluție apoasă de sulfat de magneziu.
Imaginează-ți surpriza când a văzut că firul scufundat în lichid a fost în curând acoperit cu bule de gaz. Aceasta însemna că în vas avea loc un fel de reacție chimică. Soluția inițial limpede a devenit tulbure după două ore. Faraday, care a efectuat multe experimente chimice, și-a dat seama cu ușurință motivul acestui fenomen: sulfatul de magneziu conținut în soluție s-a descompus sub influența unui curent electric provenit de la o baterie mică. Din pulberea albă formată în acest caz - oxid de magneziu sau magnezie - soluția a devenit tulbure.
Deși Faraday a înțeles cauzele și cursul fenomenelor pe care le-a observat, a fost totuși extrem de surprins de faptul că un curent electric - și unul care provenea dintr-o baterie atât de mică - ar putea provoca o reacție chimică. Înaintea lui, nimeni nu a acordat atenție existenței acestui lucrufenomene. Tânărul Michael Faraday a descoperit acest fenomen și l-a numit electroliză. Și-a propus să studieze acest proces.
La mulți ani după experimentul descris, Faraday a descoperit două legi ale electrolizei, adică. reacții de descompunere chimică a unei substanțe sub influența unui curent electric.
Între timp, anul 1812 se apropia de sfârșit. La Royal Institution au fost anunțate patru prelegeri publice susținute de fizicianul englez Sir Humphry Davy. Faraday a visat să ajungă pe ei. Datorită ajutorului unuia dintre clienții atelierului de legătorie, care cunoștea pasiunea tânărului ucenic, acest lucru s-a făcut. Poate că Sir Davy nu a avut un ascultător mai atent decât Faraday, care a prins literalmente fiecare cuvânt al celebrului fizician. Apoi și-a rescris cu sârguință rezumatul, l-a însoțit cu desene, o pagină de titlu și o dedicație, l-a legat frumos și, împreună cu o scrisoare de intenție care exprimă cel mai profund respect și reverență, i-a trimis-o lui Humphry Davy.
Dacă Faraday a cerut sau nu un post de asistent de laborator la Instituția Regală, așa cum au sugerat unii, este greu de stabilit acum, dar un lucru este sigur. În primăvara anului 1814, cu sprijinul lui Davy, care era atunci directorul institutului, Michael Faraday a fost înscris în laborator. A primit două camere mici de mansardă și un salariu săptămânal de 25 de șilingi.
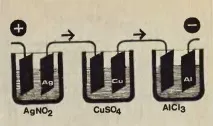
Astfel a început cariera științifică a lui Faraday, care, în ciuda numeroaselor dificultăți, a obținut neobosit noi succese. De-a lungul timpului, a devenit angajat al lui Davy, apoi i-a luat locul. Faraday era interesat de multe fenomene. Studiul electrolizei i-a permis, după cum știm deja, să descopere două legi care guvernează acest proces. Prima dintre ele spune că greutatea substanței eliberate sau descompuse în timpul trecerii curentului este proporțională cu cantitatea deelectricitate. Pentru a ilustra a doua lege a electrolizei, puteți folosi figura care reprezintă dispozitivul folosit de Faraday. În fiecare dintre cele trei vase cu soluții apoase de nitrat de argint, sulfat de cupru și clorură de aluminiu, omul de știință a scufundat doi electrozi, conectându-i în serie cu o baterie electrică folosind o bucată de sârmă. S-a dovedit că cantitatea de metal izolată în fiecare dintre vase, adică. argint, cupru și aluminiu, era exact în raportul în care aceste metale ar participa la o reacție chimică. Pentru 108 grame de argint, au fost 31,7 grame de cupru și 9 grame de aluminiu. A fost posibil să se măsoare cantitatea de energie electrică necesară pentru a elibera cantitatea indicată de metale. A fost egal cu aproximativ 96.500 coulombs/geq. Această constantă a fost numită după marele fizician englez prin numărul Faraday. Alte substanțe s-au comportat exact în același mod ca și soluțiile de mai sus. Indiferent de natura compusului chimic supus electrolizei, greutatea metalului sau a gazului eliberat pe electrozi a fost strict definită. Ar putea fi calculată prin cunoașterea proprietăților chimice ale produselor de electroliză, a duratei reacției și a puterii curentului.
JERZY WIERZHOWSKI Revista „Orizont de tehnologie pentru copii” Nr. 2-75g.